Diabète type 2
Les causes du diabète
Les études d’autopsie montrent qu’au moment au le diabète de type 2 est diagnostiqué, la moitié des cellules bêta a peut-être été tué. L’absorption du mauvais cholestérol (LDL) peut causer la mort des cellules β à la suite de la formation de radicaux libres. Les régimes riches en gras saturés ne provoquent non pas seulement l’obésité et la résistance à l’insuline, mais également l’augmentation des niveaux de gras libres circulant dans le sang appelés AGNE (Acide Gras Non Estérifiés) provoque la mort des cellules β et peut donc contribuer à la perte progressive des cellules β dans le diabète de type 2. Ce résultat est aussi valable sur des individus vivants et pas seulement des tubes à essai. Si on infuse du gras dans la circulation sanguine de personnes, ça peut directement nuire à la fonction des cellules β-pancréatiques. La même chose se produit quand c’est ingéré via l’alimentation (1).
En exposant directement les cellules bêta humaines au gras (boite de Pétri), une augmentation chronique des taux de lipides sanguins est nocive comme le montre les effets importants sur la lipotoxicité des cellules bêta pancréatiques. Les produits de dégradation des gras peuvent interférer avec la fonction de ces cellules et ultimement les conduire à leurs morts (2). Et pas n’importe quelle gras, les gras saturés. Le gras prédominant dans les olives, les noix et les avocats (Oléate)donnent une petite hausse de DP5 (protéine de la mort), tandis que le gras saturé accroît significativement ce contributeur de mort des cellules bêta (fig2). Les gras saturés sont nocifs pour les cellules β, nocifs pour les cellules produisant de l’insuline dans le pancréas (3).
Le diabète de type 2 est caractérisé par des défauts dans la sécrétion d’insuline et l’action de l’insuline et les gras saturés semblent nuire aux deux. L’ingestion de gras saturés réduit la sensibilité de l’insuline en quelques heures. Le test a été fait sur des personnes non diabétique, donc le pancréas aurait dû être capable de stimuler la sécrétion d’insuline pour égaler, mais la sécrétion d’insuline n’a pas compensé pour la résistance à l’insuline chez les sujets qui ont ingéré le gras saturé. Ceci laisse entendre que le gras saturé a aussi nuit à la fonction des cellules β quelques heures après que le gras est pénétré la bouche (4).
La consommation accrue de gras saturé a un effet puissant à court et long terme sur l’action de l’insuline contribuant à la dysfonction et la mort des cellules β du pancréas dans le diabète (5,3).
Le gras saturé n’est pas seulement nocif pour le pancréas. Les gras trouvés principalement dans la viande et les produits laitiers sont presque universellement toxiques, alors que le gras monoinsaturés ne le sont pas (6).
Le gras saturé a été jugé particulièrement toxique aux cellules hépatiques dans la formation de la stéatose hépatique (7). Ceci peut expliquer pourquoi des apports plus élevés en gras saturés et en cholestérol sont associés à une stéatose hépatique et non alcoolique (8).
En réduisant la consommation de gras saturé, nous pouvons être en mesure d’aider à interrompre ce processus. La diminution de l’apport en gras saturé peut aider à baisser le besoin de tout cet excès d’insuline. Alors, être gros ou manger des gras saturés peuvent tout deux causer un excès d’insuline dans le sang. L’effet de réduire l’apport alimentaire de gras saturés sur les niveaux d’insuline est important. Indépendamment du gras abdominal possédé par l’Homme (9).
Et ce n’est pas seulement qu’en mangeant du gras que nous sommes le plus susceptibles de le stocker en gras corporel. Les gras saturés, indépendamment de tout rôle qu’ils ont à nous faire grossir, peuvent contribuer au développement de la résistance à l’insuline et toutes ses conséquences cliniques (10).
Après avoir tenu compte pour le poids, l’alcool, le tabagisme, l’exercice et les antécédents familiaux, l’incidence du diabète était significativement associée avec la proportion de gras saturé dans le sang (11).
Ce qui cause le diabète est la consommation de trop de calories riches en gras saturés. Les régimes riches en gras saturés sont actuellement considérés comme la cause du diabète de type 2 (12).
La cause de la résistance à l’insuline
En 1927, il a été constaté sur une étude comparative, avec d’un côté un groupe ayant une alimentation riche en graisse, de l’autre côté un groupe avec une alimentation riche en glucide. Dans les deux jours qui ont suivis, l’intolérance au glucose monte en flèche dans le groupe gras. En réponse au même défi de l’eau sucrée, le groupe qui avait accumulé le gras, a fini avec deux fois plus de sucre sanguin (chart 7) (13). La glycémie connait des pointes quand la quantité de gras alimentaire augmente.
Ce mécanisme par lequel la graisse, saturé surtout, induit une résistance à l’insuline étant inconnu jusqu’à ce que des techniques d’IRM sophistiquées soient développés pour voir ce qui se passait à l’intérieur des muscles des gens quand on leur injectait de la graisse dans le sang. Il a été découvert que l’élévation du taux de graisse dans le sang provoque une résistance à l’insuline en inhibant le transport du glucose dans les muscles (15). Cela peut se produire dans les trois heures. Une dose de graisse peut commencer à causer une résistance à l’insuline empêchant l’absorption du glucose après seulement 160 minutes (16). La même chose arrive aux adolescents. En injectant de la graisse dans leur sang, elle s’accumule dans leurs muscles et diminue leur sensibilité à l’insuline montrant que l’augmentation de la graisse dans le sang peut être un facteur important de résistance de l’insuline (17). Inversement, en abaissant le niveau de graisse dans le sang et la résistance à l’insuline s’effondre. En éliminant la graisse du sang, on élimine le sucre du sang (18). On peut diminuer la résistance à l’insuline, cause du diabète de type 2, en diminuant l’apport en graisses saturées.
Les causes alimentaires du diabète
Le rôle de la viande
Le surpoids et l’obésité sont deux facteurs connus de risque important pour le diabète de type 2. Le rôle de l’alimentation n’était que secondaire, surtout concernant le rôle de certains aliments en particulier. Une méta-analyse de 2013 a révélé un risque significativement plus élevé associé à la consommation totale de viande. En particulier, la consommation de viande transformée et de volailles (fig. 1). Les raisons sont potentiellement multiples et il y aurait plusieurs potentiels coupables dans la viande (Table 2) incluant la graisse saturée et la grasse animale, possiblement les gras trans que l’on retrouve naturellement dans la viande, peut-être le cholestérol ou la protéine animale. Le fer héminique dans la viande peut entraîner des radicaux libres et ce stress oxydatif peut entrainer une inflammation chronique puis le diabète de type 2. Les PTG (Produits terminaux de la glycation ou en anglais AGE : Advanced glycation end products) sont un autre problème, ils favorisent le stress oxydatif et l’inflammation. Les analyses des aliments montrent que les plus fortes concentrations de ces glycotoxines se trouvent dans la viande. En particulier dans la viande rôti, frit ou grillée (19). Bien que toute alimentation animale puisse être puisse être une source importante et puissante de ces acides pro-oxydants, de ces produits chimiques. Dans cette étude, ils ont nourri des diabétiques avec de la nourriture emballée avec des glycotoxines comme du poulet, poissons et œufs (Table 2). Leurs marqueurs inflammatoires ont augmenté, tel que le facteur de nécrose tumorale, la protéine C-réactive et les molécules d’adhérence aux cellules vasculaires. Ainsi, les PTG alimentaires favorisent les médiateurs inflammatoires, entraînant des lésions tissulaires (20). La restriction de ce type d’aliments peut supprimer les effets inflammatoires. Des mesures appropriées pour limiter la consommation des PTG telles que l’élimination de ces aliments ou de ne manger que de la viande cuite à la vapeur peuvent réduire les incidences de ces toxines pour les diabétiques (21). Ces glycotoxines peuvent être le chaînon manquant entre la consommation accrue de graisse animale, de viandes et le développement du diabète de type 2 (22 p13).
Environ 17000 personnes ont été suivis pendant une douzaine d’année. Ils ont constaté une augmentation du risque de 8% pour une consommation quotidienne de 50g de viande. Ça pourrait être les glycotoxines, les graisses saturées, les gras trans ou le fer héminique qui pourrait favoriser la formation de nitrosamines (carcinogène). Mais il semble également que les personnes travaillant directement avec la viande sont plus touchées par le diabète. Il existe peut-être une sorte d’agent infectieux zoonotique causant le diabète comme les virus dans les morceaux de viandes fraîches (volaille comprise) (23).
L’excès de stimulation de l’enzyme du vieillissement TOR par une consommation excessive de certaines nourritures peut être un facteur crucial dans l’épidémie de diabète. Mais pas n’importe quel nourriture, les protéines animales peuvent non seulement stimuler l’IGF-1 (hormone de croissance) corrélé à un risque plus élevé de cancer, mais aussi apporter une grande quantité de leucine qui stimule l’activation de mTORC1 et semble détruire les cellules bêta productrices d’insuline dans le pancréas et contribuer au diabète de type 2. Une attention particulière doit être portée sur la consommation de produits carnés (viandes, poissons, produits laitiers) (24).
Il est clair que le régime alimentaire occidental ainsi que les modes de vies (ici américain dans l’étude, mais il est au final similaire au régime européen) contribuent à l’épidémie de diabète et d’obésité. Il ne faut pas non plus négliger l’exposition aux divers polluants industriels qui a eux seuls induisent une augmentation du poids et de la résistance à l’insuline. Cette exposition peut-être la cause sous-estimée de l’obésité et du diabète. En considérant ce qui arrive aux bébés. L’obésité chez les enfants de six mois n’est pas liée au régime alimentaire ou manque d’activité physique. Ils sont exposés à des produits chimiques de leurs mères directement par le cordon ombilical dont certains peuvent être obésogènes (25). Mais la majeure partie de l’exposition humaine vient de nos jours à l’ingestion d’aliments contaminés résultant de la bioaccumulation dans la chaîne alimentaire (comprenant également le lait quel que soit l’espèce). La principale source de consommation des polluants (environ 95%) provient de la consommation de graisse animale (26).
Le rôle des œufs
La consommation d’œufs est impliquée dans le développement d’autres maladies chroniques. Des chercheurs ont observé une hausse graduelle du risque de diabète avec l’augmentation de la consommation d’œufs. Ne manger qu’un seul œuf semble augmenter le risque de développer le diabète de 76%. Deux œufs par semaine double le risque (97%), et un œuf par jour le triple (Table 2). Trois fois plus de chance d’avoir le diabète de type 2, une des principales causes de décès, d’amputation, de cécité et d’insuffisance rénale (27).
En 2009, des chercheurs de Harvard ont découvert que consommer un seul œuf par jour ou plus est associé à un risque accru de diabète de type 2 chez l’homme et la femme (28). Résultat confirmé en Asie en 2011 (29). En Europe en 2012, le niveau de consommation d’œufs, associé à un plus grand risque de diabète équivaut à moins d’un œuf par jour (30). L’effet semble moindre sur les personnes de plus de 70 ans (31).
Une fois le diabète installé, les œufs peuvent précipiter le décès. Manger un œuf ou plus par jour semble raccourcir la durée de vie de façon général (table 4) mais doubler le risque toute cause confondue pour ceux atteint de diabète (Table 5) (32).
Le rôle du poisson
De nombreuses (six) méta-analyses ont été publiées sur la relation entre la consommation de poisson et le diabète de type 2 (33, 34, 35, 36, 37, 38). Avec des résultats concordants sur le fait que les consommateurs de poissons ont tendance à être plus à risque pour le diabète (38%) (fig 3 35) revenant à une augment du risque de 5% pour chaque portion de poisson consommé par semaine (fig 2 36). Une portion de viande (100g) étant associée à une risque accrue de 19% pour une consommation journalière. Le poisson serait plus néfaste que la viande rouge pour le diabète car les graisses des oméga-3 pourraient augmenter le risque de diabète de type 2 en augmentant le taux de sucre dans le sang. Ou peut être parce que les oméga-3 provoquent un stress oxydatif ou à cause des contaminants s’accumulant dans les poissons(37).
Une étude de 2013 a révélé que les cellules productrices d’insuline dans le pancréas ne fonctionnent pas aussi bien chez les personnes mangeant deux ou plusieurs portions de poissons par semaine (39).
Les traitements médicamenteux et changement de style de vie
Les personnes atteintes de diabète de type 2 ont un risque plus élevé pour un certain nombre de problèmes de santé graves, comme les maladies cardiaques, la mort prématurée, la cécité, l’insuffisance rénale, les amputations, les fractures, la fragilité, la dépression et le déclin cognitif. Plus les gens ont un taux élevé de sucre dans le sang, plus ils ont des crises cardiaques, accidents vasculaires cérébraux, courte durée de vie et plus les risques de complications sont élevés comme la cécité ou l’insuffisance rénale. Ainsi, une étude a été conçu ou 10000 diabétiques ont été randomisés dans une intervention intensive hypoglycémiante où ils ont mis les gens sous 1, 2, 3, 4 ou 5 différentes classes de médicaments avec ou sans insuline (table 2) pour faire baisser les taux de sucre sanguin dans l’intervalle normal. Les résultats sont les suivants : la diminution intensive des taux de sucre sanguin avec des médicaments a augmenté la mortalité. Après avoir examiné les tendances de la mortalité, ils ont conclu que le préjudice associé à l’augmentation du risque de décès dépassait tout bénéfice potentiel. Ils ont donc arrêté prématurément l’étude pour des raisons de sécurité. Ils ont réussi à diminuer le taux de sucre dans le sang des gens mais en essayant de pousser l’hémoglobine A1c des personnes en dessous de 6 (fig 1). L’augmentation de la mortalité est peut-être du aux effets indésirables des médicaments pour traiter la maladie (40).
L’insuline injectée peut favoriser le cancer, l’obésité, l’athérosclérose, aggraver la rétinopathie diabétique et accélérer le vieillissement (41). L’insulinothérapie peut favoriser les inflammations dans la paroi des artères (42) expliquant les résultats précédemment (40) ou même d’autres donnant des résultats identiques avec aucune réduction des complications macrovasculaires, crises cardiaques, AVC malgré une baisse du taux de sucre sanguin. La thérapie intensive a permis une réduction de 21% des complications dans le développement des complications microvasculaire comme la dysfonction rénale (43).
Les quelques avantages doivent être évalués par rapport au risque accru de mourir, l’augmentation du gain de poids, risque d’hypoglycémie sévère chez les patients traités intensivement. Essayer de normaliser les taux de sucre dans le sang (HbA1c à 6% ou moins) des personnes est une stratégie imprudente (44). Ces études se concentraient exclusivement sur les traitements médicamenteux, mais n’abordaient jamais sérieusement les régimes alimentaires et les changements de styles de vie (45).
Une étude a constaté qu’une intervention intensive sur le style de vie mettant l’accent sur la perte de poids n’a pas réduit le taux d’événements cardiovasculaires comme les crises cardiaques chez les adultes en surpoids ou obèses atteints de diabète de type 2. Ça n’a pas augmenté leur risque de décès mais ça ne l’a pas non plus diminué. L’étude a été interrompu après environ 10 ans sur la base de futilité ; ils ont perdu du poids, mais ils ne mourraient pas moins (46). Ce qui peut se voir ailleurs, l’intervention alimentaire ne tuait personne, mais ça n’aidait pas à mieux les faire vivre (47). La raison est que l’alimentation n’était en soit pas plus saine. Il y avait juste un régime avec des restrictions caloriques, ce qui signifie le même régime néfaste qui a amené les gens à devenir malades mais avec de plus petites portions. Si les personnes mangent moins, font plus d’exercice, elles perdent du poids, sont plus en forme physiquement, plus mince et avoir un meilleur contrôle de la glycémie (Figure 1) mais tant que les régimes ne seront pas sains pour le cœur, que le cholestérol LDL ne s’améliore pas, ça n’améliorera pas l’état des artères (46).
Avec les traitements médicamenteux, la cause sous-jacente de la maladie n’est pas traitée, il n’y a pas de tentative de soigner la maladie réelle, ça ne fait qu’abaisser l’un des effets de la maladie (les taux de sucres dans le sang) par tous les moyens nécessaire. L’espoir était d’empêcher certaines complications dévastatrices (40).
Inverser le diabète par l’alimentation
Il est connu que le diabète de type 2 pouvait être inversé par une réduction extrême de la prise alimentaire depuis près d’un siècle et demi. À Paris, en 1870, durant le siège de Paris lors de la guerre franco-prussienne par Claude Bouchardet (48). Ça a depuis été démontré expérimentalement, qu’en affamant suffisamment des personnes, on pouvait inverser le diabète (49). Les spécialistes du diabète savent que la minuscule proportion de diabétiques ayant une volonté de fer en diminuant sensiblement leur poids et le maintenir peuvent présenter un retour à un métabolisme normal (50). Il est nécessaire pour les médecins de pouvoir reconnaitre ce type de profil et de gérer convenablement ce sous-groupe qui est prêt à tout pour se débarrasser de son diabète. Ce sont les « Motivés-Santé » (Health-Motivated). Au moment du diagnostic, les Motivés-Santé seront informés qu’ils sont susceptibles d’être en mesure d’inverser leur diabète en perdant jusqu’à un cinquième de leur poids corporel. Et, s’ils ne sont pas montrés suffisamment motivés, les recommandations de routine pour la gestion du diabète de type 2 sont mises en œuvre, à savoir un traitement lourd en médicaments (51). Bizarrement, la solution de facilité (médicamenteuse) induit à terme, beaucoup plus de contraintes. Le contrôle de la glycémie avec des médicaments est difficile à maintenir et peut en fait exacerber l’obésité, faire prendre plus de poids, ce qui crée un cercle vicieux (52).
Une alimentation qui met l’accent sur tous les légumes que vous voulez manger. Beaucoup de légumes, des haricots, des céréales complètes, des noix et des graines, à base de plante pour au moins 90%, donc au moins une grande salade chaque jour. Environ 1 livre (450g environ) de légumes crus, une souple légumes-haricot, une poignée de noix et de graines, des fruits à chaque repas, une livre de légumes verts cuits, quelques céréales complètes, mais pas de céréales raffinées, de malbouffe, ni d’huile et une restriction sur les produits d’origine animale. Treize hommes et femmes diabétiques ont suivis cette alimentation durant une moyenne de sept mois et âgé entre 30 et 80 ans. Les personnes testées sont des diabétiques de plus de sept ans en moyenne. Ils ont relevé au fil des mois les niveaux d’hémoglobine A1c (fig. 1.a). Dès le début du test, ou ils se mettent à consommer des plantes en grande quantité, le niveau de HbA1c moyen a chuté de 8.2 à 5.8 au bout de sept mois (une valeur en dessous de 6 est considéré comme non diabétique, une valeur comprise entre 6 et 7 correspond à un diabète contrôlé, au-dessus de 7, un diabète non contrôlé). La majorité des participants ont eu des niveaux ayant chuté dans des valeurs normales ceci après avoir arrêté la plupart de leurs médicaments. Malgré le faible nombre de participants, l’absence de groupe de contrôle, avec seulement des personnes pouvant tenir le régime, l’ampleur de l’effet obtenu indique qu’une alimentation à haute densité d’éléments nutritifs peut-être très efficace pour certaines personnes (53).
La suppression du diabète devrait être un objectif dans la gestion du diabète de type 2 (54). Pas seulement sont traitement, le diabète de type 2 peut-être inversé comme vu précédemment, pas seulement avec un régime hypocalorique (49), il peut aussi l’être avec une alimentation saine à base de plantes. Le problème est de savoir si ce sont les plantes ou la perte de poids qui a permis d’inverser le diabète. Dans l’étude de Dunaief, les sujets avaient tous perdus du poids (fig. 1.b) (53). Tout autant que les sujets ayant suivi un régime hypocalorique (49). L’important est-il de manger suffisamment peu pour perdre du poids ? Même si au final, l’étude hypocalorique à base de sucre, lait en poudre, sirop de maïs et huile sont très peu recommandable et pouvant être suivi sur le long terme. Il est possible et préférable de manger de la vraie nourriture, de grandes quantités de nourritures basse-calorie qu’il est possible de se gaver. Même si c’est une version différente d’un régime pauvre en calorie, elle restera plus saine. Il est à noter que même les participants n’ayant que peu perdu voir pris du poids entre deux mesures ont semblé amélioré leur diabète. Les effets de ce régime semblent aller au-delà de la perte de poids (53).
En 1930, des traitements réussi du diabète de type 2 avec un régime à base de plantes a été montré. Fournissant des preuves qu’un régime centré autour de légumes, de fruits, de céréales et de haricots étaient plus efficaces pour contrôler le diabète que tout autre traitement diététique. Un essai contrôlé randomisé montre que les besoins en insuline ont été réduits de moitié. Un quart des participants ont complétement arrêtés l’insuline (Table 2) (56). Mais il s’agissait ici également d’un régime hypocalorique comme celui de Dunaief (53).
Des résultats similaires furent rapportés 20 ans plus tard avec Walter Kempner et sa diet du riz et de fruits, montrant pour la première fois la régression documentée de la rétinopathie diabétique chez un quart de ses patients. Par exemple, une femme diabétique de 60 ans, déjà aveugle d’un œil, et pouvait seulement voir que les contours des grands objets avec l’autre. Cinq ans plus tard, avec cette alimentation, ça n’a pas empiré, au contraire, ça s’est amélioré en plus de ne plus prendre de l’insuline avec des taux glycémiques normaux et une baisse de 100 points de son cholestérol. Ou de simplement être capable de lire les gros titres à être capable de lire le journal complet quatre mois plus tard pour un autre patient (57). Mais avec cette étude, il n’est toujours pas possible de savoir si c’est le changement alimentaire ou les restrictions caloriques induites par des aliments à basses calories qui ont permis ces améliorations. Le régime du riz de Kempner est un régime faible en sodium, protéine et gras animales.
Encore 20 ans plus tard, une nouvelle étude qui cette fois passe d’une alimentation entièrement végétale mais ayant des quantités caloriques tel, que les patients ne pouvaient ni ne devaient perdre de poids. Les sujets ont été pesés quotidiennement et s’ils ont commencé à perdre du poids ils les faisaient manger plus de nourriture. Tellement de nourriture que certains des participants avaient du mal à tout manger. Les participants se sont adaptés, il n’y avait alors pas de changements significatifs de leurs poids malgré les restrictions de viande, œufs et produits laitiers. Le régime était basé sur des plantes complètes comme des grains entiers, haricots, légumes et fruits pour fournir 65g de fibres par jour (4 fois plus que l’apport moyen en fibres en France). Le régime de contrôle utilisé est celui du régime diabétique conventionnel (ayant déjà une quantité de fibres alimentaires plus importante que les apports moyen en occident). En table 3, on peut voir les exigences en insuline avant et après la diet HCF (High-carbohydrate, high plant fiber) des 20 personnes qu’ils ont mis sur le régime. Gloablement, les besoins en insuline ont été réduits d’environ 60% et la moitié ont pu arrêter complétement malgré l’absence de perte de poids. Cette évolution a eu lieu en 16 jours seulement, même pour des diabétiques de longue durée (jusqu’à 20 ans) (Table 1). Par exemple le patient #15 (fig 1) avait besoin de 32 unités d’insuline (1ml contient 100 unités d’insuline, 0,3ml contient 30 unités d’insuline) quotidienne sur le régime de contrôle. 18 jours plus tard, il n’avait plus besoin d’injection d’insuline. Pour tous les participants, le cholestérol a énormément chuté en 16 jours (58).
Semi-conclusion
Tout comme les changements modérés dans un régime alimentaire entraînent généralement des réductions modestes en cholestérol LDL. Demander aux personnes atteintes de diabète d’apporter des changements modérés réalisent souvent des résultats tout aussi modérés. Ce qui est une raison possible pour laquelle la plupart se retrouvent avec des médicaments, des injections ou les deux (59). Des modifications alimentaires modérées pourront vous laisser un handicap modéré, comme une cécité modérée, une amputation modérée, une insuffisance rénale modérée dans le cas du diabète. Le vieil adage « Visez pour la lune » semble s’appliquer. Ceci peut être plus efficace que de limiter les patients à de petits pas qui peuvent sembler plus facile à gérer, mais ne suffit pas pour réellement enrayer la maladie (59).
La modération en tout n’est pas forcément une bonne chose. Plus le praticien de la santé demandera à ses patients, plus il aura de retours (60).
Cas de la rétinopathie diabétique
C’est le Docteur Kempner avec son régime à base de riz et fruits qui a réussi à avoir des résultats positifs. Refusant d’accepter des résultats non mesurés objectivement comme preuve de succès (61 p63), il fit des mesures objectives dont les plus connues étaient ses photographies oculaires permettant de visualise le fond de l’œil. Il a alors prouvé que le régime alimentaire pouvait non seulement arrêter le saignement, les suintements, et les enflements visibles au fond de l’œil chez les personnes souffrant de graves problèmes rénaux, hypertendus ou cardiaques mais aussi l’inverser (voir photo ci-dessous, avant à gauche et après à droite.). Une inversion tel que le patient pouvait à nouveau être capable de lire des caractères d’imprimerie alors qu’il n’était pas capable de distinguer des objets. Un renversement de la cécité par le régime (62).
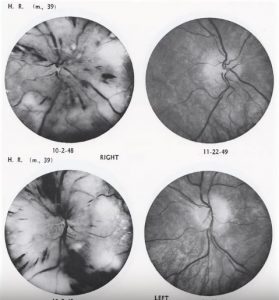
Les médicaments contre l’hypertension artérielle ont fait presque disparaitre les cas de rétinopathie hypertensive, mais il existe toujours de cas de rétinopathie diabétique qui reste une cause majeure de cécité dans le monde occidental (63). Même avec un traitement intensif du diabète, avec au moins trois injection quotidienne d’insuline avec la meilleure technologie comme les pompes à insuline implantable. Le meilleur qui est faisable avec ce genre de traitement c’est le ralentissement de la progression de la maladie, de la rétinopathie (64). Alors qu’il était possible de recouvrer la vue il y a plus de cinquante ans, il n’est aujourd’hui possible que de retarder le développement de la maladie. Cette inversion de la maladie à base d’un changement de régime alimentaire très faible en sodium, protéine et gras animal, cholestérol pour remédier aux insuffisances rénales et cardiaque mais supposé aggraver le diabète. Il prévoyait qu’un régime à 90% de glucides augmenterait les besoins en insuline. Cependant, le contraire c’est avéré vrai. Il accepta les 100 premiers patients avec du diabète et qui ont suivi le régime du riz pendant au moins trois moins. Leur glycémie à jeun avait chuté malgré la baisse d’insuline qu’il prenait (Table 1). 44% d’entre eux souffraient de rétinopathie diabétique. Dans 30% des cas, leurs yeux s’étaient améliorés. Elle était considérée à l’époque comme irréversible. Ils sont passé d’une cécité les rendant incapable de lire un texte à une vision qualifiée de normale. Encore une fois, l’amélioration avait également lieu pour des personnes n’ayant pas une perte significative de poids (65).
Aujourd’hui les traitements de la rétinopathie n’ont pas suivi les travaux du Docteur Kempner. Les traitements consistent en la photocoagulation au laser dans un premier temps. Et, si ça ne fonctionne pas, d’essentiellement brûler au laser le fond des yeux car en théorie ce qui reste bénéficiera d’une meilleur circulation sanguine (66).
Les recommandations des associations et des organismes étatiques
- M Cnop. Fatty acids and glucolipotoxicity in the pathogenesis of Type 2 diabetes. Biochem Soc Trans. 2008 Jun;36(Pt 3):348-52. doi: 10.1042/BST0360348.
- D Estadella, C M da Penha Oller do Nascimento, L M Oyama, E B Ribeiro, A R Dâmaso, A de Piano. Lipotoxicity: effects of dietary saturated and transfatty acids. Mediators Inflamm. 2013;2013:137579. doi: 10.1155/2013/137579.
- D A Cunha, M Igoillo-Esteve, E N Gurzov, C M Germano, N Naamane, I Marhfour, M Fukaya, J M Vanderwinden, C Gysemans, C Mathieu, L Marselli, P Marchetti, H P Harding, D Ron, D L Eizirik, M Cnop. Death protein 5 and p53-upregulated modulator of apoptosis mediate the endoplasmic reticulum stress-mitochondrial dialog triggering lipotoxic rodent and human β-cell apoptosis. Diabetes. 2012 Nov;61(11):2763-75. doi: 10.2337/db12-0123.
- C Xiao, A Giacca, A Carpentier, G F Lewis. Differential effects of monounsaturated, polyunsaturated and saturated fat ingestion on glucose-stimulated insulin secretion, sensitivity and clearance in overweight and obese, non-diabetic humans. Diabetologia. 2006 Jun;49(6):1371-9.
- W J Evans. Oxygen-carrying proteins in meat and risk of diabetes mellitus. JAMA Intern Med. 2013 Jul 22;173(14):1335-6. doi: 10.1001/jamainternmed.2013.7399.
- J Cao, X X Feng, L Yao, B Ning, Z X Yang, D L Fang, W Shen. Saturated free fatty acid sodium palmitate-induced lipoapoptosis by targeting glycogen synthase kinase-3β activation in human liver cells. Dig Dis Sci. 2014 Feb;59(2):346-57. doi: 10.1007/s10620-013-2896-2.
- A K Leamy, R A Egnatchik, J D Young. Molecular mechanisms and the role of saturated fatty acids in the progression of non-alcoholic fatty liver disease. Prog Lipid Res. 2013 Jan;52(1):165-74. doi: 10.1016/j.plipres.2012.10.004.
- G Musso, R Gambino, F De Michieli, M Cassader, M Rizzetto, M Durazzo, E Fagà, B Silli, G Pagano. Dietary habits and their relations to insulin resistance and postprandial lipemia in nonalcoholic steatohepatitis. Hepatology. 2003 Apr;37(4):909-16.
- D R Parker, S T Weiss, R Troisi, P A Cassano, P S Vokonas, L Landsberg. Relationship of dietary saturated fatty acids and body habitus to serum insulin concentrations: the Normative Aging Study. Am J Clin Nutr. 1993 Aug;58(2):129-36.
- D J Maron, J M Fair, W L Haskell. Saturated fat intake and insulin resistance in men with coronary artery disease. The Stanford Coronary Risk Intervention Project Investigators and Staff. Circulation. 1991 Nov;84(5):2020-7.
- L Wang, A R Folsom, Z J Zheng, J S Pankow, J H Eckfeldt, ARIC Study Investigators. Plasma fatty acid composition and incidence of diabetes in middle-aged adults: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Clin Nutr. 2003 Jul;78(1):91-8.
- R Taylor. Pathogenesis of type 2 diabetes: tracing the reverse route from cure to cause. Diabetologia. 2008 Oct;51(10):1781-9. doi: 10.1007/s00125-008-1116-7.
- J Shirley Sweeney. DIETARY FACTORS THAT INFLUENCE THE DEXTROSE TOLERANCE TEST A PRELIMINARY STUDY. JAMA Int Med, Dec, 1927, Vol 40, No. 6.
- M Krssak, K Falk Petersen, A Dresner, L Dipetro, S M Vogel, D L Rothman, M Roden, G I Shulman. Intramyocellular lipid concentrations are correlated with insulin sensitivity in humans: a 1H NMR spectroscopy study. Diabetologia. 1999 Jan;42(1):113-6.
- M Roden, T B Price, G Perseghin, K F Petersen, D L Rothman, G W Cline, G I Shulman. Mechanism of free fatty acid-induced insulin resistance in humans. J Clin Invest. Jun 15, 1996; 97(12): 2859–2865.
- M Roden, K Krssak, H Stingl, S Gruber, A Hofer, C Furnsinn, E Moser, W Waldhausl. Rapid impairment of skeletal muscle glucose transport/phosphorylation by free fatty acids in humans.
- S Lee, C Boesch, J L Kuk, S Arsianian. Effects of an overnight intravenous lipid infusion on intramyocellular lipid content and insulin sensitivity in African-American versus Caucasian adolescents. Metabolism. 2013 Mar;62(3):417-23.
- A T Santomauro, G Boden, M E Silva, D M Rocha, FR F Santos, M J Ursich, P G Strassmann, B L Wajchenberg. Overnight lowering of free fatty acids with Acipimox improves insulin resistance and glucose tolerance in obese diabetic and nondiabetic subjects. Diabetes. 1999 Sep;48(9):1836-41.
- EJ Feskens, D Sluik, GJ van Woudenbergh. Meat consumption, diabetes, and its complications. Curr Diab Rep. 2013 Apr;13(2):298-306
- H Vlassara, W Cai, J Crandal, T Goldberg, R Oberstein, V Dardaine, M Peppa, EJ Rayfield. Inflammatory mediators are induced by dietary glycotoxins, a major risk factor for diabetic angiopathy. Proc Natl Acad Sci U S A. 2002 Nov 26;99(24):15596-601.
- T Koschinsky, CJ He, T Mitsuhash, R Bucala, C Liu, C Buenting, K Heitmann, H Vlassara. Orally absorbed reactive glycation products (glycotoxins): an environmental risk factor in diabetic nephropathy. Proc Natl Acad Sci U S A. 1997 Jun 10;94(12):6474-9
- M Peppa, T Goldberg, W Cai, E Rayfield, H Vlassara. Glycotoxins: a missing link in the « relationship of dietary fat and meat intake in relation to risk of type 2 diabetes in men ». Diabetes Care. 2002 Oct;25(10):1898-9
- InterAct Consortium, B Bendinelli, D Palli, G Masala, SJ Sharp, MB Schulze, M Guevara, AD van der, F Sera, P Amiano, B Balkau, A Barricarte, H Boeing, FL Crowe, CC Dahm, G Dalmeijer, B de Lauzon-Guillain, R Egeberg, G Fagherazzi, PW Franks, V Krogh, JM Huerta, P Jakszyn, KT Khaw, K Li, A Mattiello, PM Nilsson, K Overvad, F Ricceri, O Rolandsson, MJ Sánchez, N Slimani, I Sluijs, AM Spijkerman, B Teucher, A Tjonneland, R Tumino, SW van den Berg, NG Forouh, C Langeberg, EJ Feskens, E Riboli, NJ Wareham. Association between dietary meat consumption and incident type 2 diabetes: the EPIC-InterAct study. Diabetologia. 2013 Jan;56(1):47-59
- R Zoncu, A Efeyan, DM Sabatin. mTOR: from growth signal integration to cancer, diabetes and ageing. Nat Rev Mol Cell Biol. 2011 Jan;12(1):21-35
- MA Hyman MA. Environmental toxins, obesity, and diabetes: an emerging risk factor. Altern Ther Health Med. 2010 Mar-Apr;16(2):56-8
- DJ Magliano, VH Loh, JL Harding, J Botton, JE Shaw. Persistent organic pollutants and diabetes: a review of the epidemiological evidence. Diabetes Metab. 2014 Feb;40(1):1-14
- L. Radzevivcienė, R. Ostrauskas. Egg consumption and the risk of type 2 diabetes mellitus: a case-control study. Public Health Nutr. 2012 15(8):1437 – 1441.
- L. Djoussé, J. M. Gaziano, J. E. Buring, I.-M. Lee. Egg consumption and risk of type 2 diabetes in men and women. Diabetes Care 2009 32(2):295 – 300.
- Z. Shi, B. Yuan, C. Zhang, M. Zhou, G. Holmboe-Ottesen. Egg consumption and the risk of diabetes in adults, Jiangsu, China. Nutrition 2011 27(2):194 – 198.
- U. Ericson, E. Sonestedt, B. Gullberg, S. Hellstrand, G. Hindy, E. Wirfält, M. Orho-Melander. High intakes of protein and processed meat associate with increased incidence of type 2 diabetes. Br. J. Nutr. 2013 109(6):1143 – 1153.
- L. Djoussé, A. Kamineni, T. L. Nelson, M. Carnethon, D. Mozaffarian, D. Siscovick, K. J. Mukamal. Egg consumption and risk of type 2 diabetes in older adults. Am. J. Clin. Nutr. 2010 92(2):422 – 427
- L. Djoussé, J. M. Gaziano. Egg consumption in relation to cardiovascular disease and mortality: the Physicians’ Health Study. Am. J. Clin. Nutr. 2008 87(4):964 – 969.
- M Zhang, E Picard-Deland, A Marette. Fish and Marine Omega-3 Polyunsatured Fatty Acid Consumption and Incidence of Type 2 Diabetes: A Systematic Review and Meta-Analysis. Int J Endocrinol. 2013 2013:501015 Epub 2013 Sep 8.
- JS Zheng, T Huang, J Yang, YQ Fu, D Li. Marine N-3 polyunsaturated fatty acids are inversely associated with risk of type 2 diabetes in Asians: A systematic review and meta-analysis. PLoS ONE. 2012 7(9):e44525.
- JHY Wu, R Micha, F Imamura, A Pan, ML Biggs, O Ajaz, L Djousse, FB Hu, D Mozaffarian. Omega-3 fatty acids and incident type 2 diabetes: A systematic review and meta-analysis. Br J Nutr. 2012 107 – Suppl – 2:S214 – 27.
- A Wallin, D Di Giuseppe, N Orsini, PS Patel, NG Forouhi, A Wolk. Fish consumption, dietary long-chain n-3 fatty acids, and risk of type 2 diabetes: Systematic review and meta-analysis of prospective studies. Diabetes Care. 2012 35(4):918 – 929.
- Y Zhou, C Tian, C Jia. Association of fish and n-3 fatty acid intake with the risk of type 2 diabetes: A meta-analysis of prospective studies. Br J Nutr. 2012 108(3):408 – 417.
- P Xun, K He. Fish Consumption and Incidence of Diabetes. Diabetes Care. 2012 35(4):930–938.
- C Lee, A Liese, L Wagenknecht, C Lorenzo, S Haffner, A Hanley. Fish consumption, insulin sensitivity and beta-cell function in the Insulin Resistance Atherosclerosis Study (IRAS). Nutr Metab Cardiovasc Dis. 2013 23(9):829 – 835.
- Action to Control Cardiovascular Risk in Diabetes Study Group, H C Gerstein, M E Miller, R P Byington, D C Goff Jr, J T Bigger, J B Buse, W C Cushman, S Genuth, F Ismail-Beigi, R H Grimm Jr, J L Probstfield, D G Simons-Morton, W T Friedewald. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med. 2008 Jun 12;358(24):2545-59.
- M V Blagosklonny. Prospective treatment of age-related diseases by slowing down aging. Am J Pathol. 2012 Oct;181(4):1142-6.
- R Madonna, A Pandolfi, M Massaro, A Consoli, R De Caterina. Insulin enhances vascular cell adhesion molecule-1 expression in human cultured endothelial cells through a pro-atherogenic pathway mediated by p38 mitogen-activated protein-kinase. Diabetologia. 2004 Mar;47(3):532-6. Epub 2004 Feb 5.
- T Terry, K Raravikar, N Chokrungvaranon, P D Reaven. Does aggressive glycemic control benefit macrovascular and microvascular disease in type 2 diabetes? Insights from ACCORD, ADVANCE, and VADT. Curr Cardiol Rep. 2012 Feb;14(1):79-88.
- F Ismail-Beigi, T Craven, M A Banerji, J Basile, J Calles, R M Cohen, R Cuddihy, W C Cushman , S Genuth, R H Grimm Jr, B P Hamilton, B Hoogwerf, D Karl, L Katz, A Krikorian, P O’Connor, R Pop-Busui, U Schubart, D Simmons, H Taylor, A Thomas, D Weiss, I Hramiak; ACCORD trial group. Effect of intensive treatment of hyperglycaemia on microvascular outcomes in type 2 diabetes: an analysis of the ACCORD randomised trial. Lancet. 2010 Aug 7;376(9739):419-30.
- P Kishore, S H Kim, J P Crandall. Glycemic control and cardiovascular disease: what’s a doctor to do? Curr Diab Rep. 2012 Jun;12(3):255-64.
- Look AHEAD Research Group, RR Wing, P Bolin, F L Brancati, G A Bray, J M Clark, M Coday, R S Crow, J M Curtis, C M Egan, M A Espeland, M Evans, J P Foreyt, S Ghazarian, E W Gregg, B Harrison, H P Hazuda, J O Hil, E S Horton, V S Hubbard, J M Jakicic, R W Jeffery, K C Johnson, S E Kahn, A E Kitabchi, W C Knowler, C E Lewis, B J Maschak-Carey, M G Montez, A Murillo, D M Nathan, J Patricio, A Peters, X Pi-Sunyer, H Pownall, D Reboussin, J G Regensteiner, A D Rickman, D H Ryan, M Safford, T A Wadden, L E Wagenknecht, D S West, D F Williamson, S Z Yanovski. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med. 2013 Jul 11;369(2):145-54.
- E S Schellenberg, D M Dryden, B Vandermeer, C Ha, C Korownyk. Lifestyle interventions for patients with and at risk for type 2 diabetes: a systematic review and meta-analysis. Ann Intern Med. 2013 Oct 15;159(8):543-51.
- S Steven, E L Lim, R Taylor. Dietary reversal of Type 2 diabetes motivated by research knowledge. Diabet Med. 2010 Jun;27(6):724-5.
- E L Lim, K G Hollingsworth, B S Arbisala, M J Chen, J C Mathers, R Taylor. Reversal of type 2 diabetes: normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia. 2011 Oct;54(10):2506-14.
- R Taylor. Pathogenesis of type 2 diabetes: tracing the reverse route from cure to cause. Diabetologia. 2008 Oct;51(10):1781-9.
- R Taylor. Banting Memorial lecture 2012: reversing the twin cycles of type 2 diabetes. Diabet Med. 2013 Mar;30(3):267-75.
- J E Varela. Bariatric surgery: a cure for diabetes? Curr Opin Clin Nutr Metab Care. 2011 Jul;14(4):396-401.
- D M Dunaief, J Fuhrman, J L Dunaief, G Ying. Glycemic and cardiovascular parameters improved in type 2 diabetes with the high nutrient density (HND) diet. Open Journal of Preventive Medicine Vol.2, No.3, 364-371 (2012).
- S Steven, E L Lim, R Taylor. Population response to information on reversibility of Type 2 diabetes. Diabet Med. 2013 Apr;30(4):e135-8.
- I M Rabinowitch. Experiences with a High Carbohydrate-Low Calorie Diet for the treatment of Diabetes Mellitus. Can Med Assoc J. 1930 Oct;23(4):489-98.
- I M Rabinowitch. Experiences with a High Carbohydrate-Low Calorie Diet for the treatment of Diabetes Mellitus. Can Med Assoc J. 1930 Oct;23(4):489-98.
- W Kempner, R L Peschel, C Schlayer. Effect of rice diet on diabetes mellitus associated with vascular disease. Postgrad Med. 1958 Oct;24(4):359-71.
- J W Anderson, K Ward. High-carbohydrate, high-fiber diets for insulin-treated men with diabetes mellitus. Am J Clin Nutr. 1979 Nov;32(11):2312-21.
- C B Trapp, N D Barnard. Usefulness of vegetarian and vegan diets for treating type 2 diabetes. Curr Diab Rep. 2010 Apr;10(2):152-8.
- D R Young, W M Vollmer, A C King, A J Brown, V J Stevens, P J Elmer, S Craddick, D L Sturtevant, D W Harsha, L J Appel. Can individuals meet multiple physical activity and dietary behavior goals? Am J Health Behav. 2009 May-Jun;33(3):277-86.
- W Kempler. Compensation of renal metabolic dysfunction. N. Car Med Jour. 1945 Feb 6(2)61 – 87.
- W Kempler. The Treatment of Retinopathy in Kidney Disease and Hypertensive and Arteriosclerotic Vascular Disease with the Rice Diet. 1951 Revista doos Tribunais.
- N Cheung, P Mitchell, T Y Wong. Diabetic retinopathy. Lancet. 2010 Jul 10;376(9735):124-36. doi: 10.1016/S0140-6736(09)62124-3.
- Diabetes Control and Complications Trial. The effect of intensive diabetes treatment on the progression of diabetic retinopathy in insulin-dependent diabetes mellitus. Arch Ophthalmol. 1995 Jan;113(1):36-51.
- W Kempner, R L Peschel, C Schlayer. Effect of rice diet on diabetes mellitus associated with vascular disease. Postgrad Med. 1958 Oct;24(4):359-71.
- T Alasil, N K Waheed. Pan retinal photocoagulation for proliferative diabetic retinopathy: pattern scan laser versus argon laser. Curr Opin Ophthalmol. 2014 May;25(3):164-70. doi: 10.1097/ICU.0000000000000048.
Commentaires récents